RNA幹擾(RNAi)是許多真核生物中一種保守的RNA沉默機製🏂🏼👵🏻, 小幹擾RNA是RNA幹擾的關鍵組成部分。在果蠅中,siRNA的產生是由Dicer-2(Dcr-2)蛋白在其輔因子Loqs-PD的輔助下🛸,從長的雙鏈RNA(dsRNA)上切割產生21個堿基對的雙鏈siRNA🤟🏽。Dicer-2是最早被發現的ATP依賴型的Dicer家族蛋白,在2000年即發現siRNA加工生成過程是ATP依賴的💁🏼♀️。近年來😩,雖然有多篇關於Dicer家族蛋白的生化與結構研究的文章發表,但是對於ATP依賴型的Dicer蛋白識別並切割RNA底物的整個過程的分子機製仍不清楚。
2022年6月29日👨🏼🍼,万达平台麻錦彪團隊與清華大學王宏偉團隊在《自然》雜誌主刊(Nature)在線發表了題為Structural insights into dsRNA processing by Drosophila Dicer-2–Loqs-PD(《果蠅Dicer-2和Loqs-PD復合物在雙鏈RNA加工過程的結構深入解析》)的文章🧜🏻♂️,該研究通過解析了包括Dicer-2-Loqs-PD單獨蛋白,以及Dicer-2–Loqs-PD在有無ATP的情況下結合dsRNA的6套冷凍電鏡結構(圖1),結合生化實驗分析,首次揭示了Dicer-2-Loqs-PD復合物結合並切割雙鏈RNA產生siRNA的依賴ATP的加工循環分子機製(圖2)🥸,解決了20多年困擾小幹擾RNA領域的關鍵科學問題👷🏻♀️。
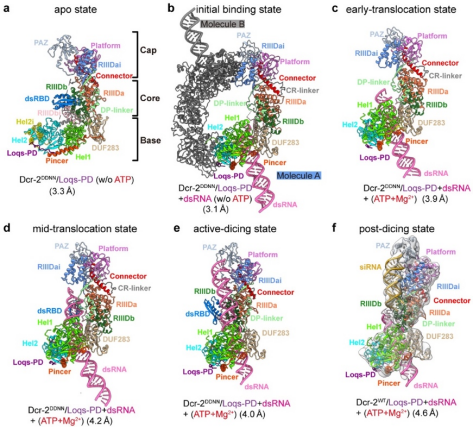
圖1. Dicer-2–Loqs-PD結合雙鏈RNA復合物在不同狀態下的冷凍電鏡結構。
此前的研究報道了Dicer-2蛋白結合底物時就會有明顯的構象變化🧎🏻,加之ATP依賴的Dicer-2蛋白在siRNA加工過程中需要通過水解ATP來在雙鏈RNA上移動,並且連續的切割過程勢必也會導致存在處於不同狀態的復合物,三者疊加勢必對復合物的均一性造成較大的影響。對此,研究團隊從活性位點突變的單獨蛋白復合物結構開始解析;之後加入了雙鏈RNA🪸,獲得了無ATP時,處在初始結合狀態的Dicer-2–Loqs-PD–dsRNA復合物高分辨結構👩🏻🎨;在此基礎上,進一步加入ATP,通過數據收集與計算分類,得到了切割活性狀態與兩種明顯具有不同結構特點的移位狀態(早起移位與中期移位狀態);然後使用正常活性的Dicer-2蛋白🧑🏼,獲得了處於切割後狀態的復合物🌲,並通過分析發現它正向早起移位狀態轉變🕵🏽♂️;從而將整個過程串起,闡明了Dicer-2–Loqs-PD復合物從結合雙鏈RNA並在其上移動🚉,到形成切割活性狀態,直至切割完成產生siRNA的整個循環過程的分子機製和其中連續且遞進的構象變化🤵🏻♀️。
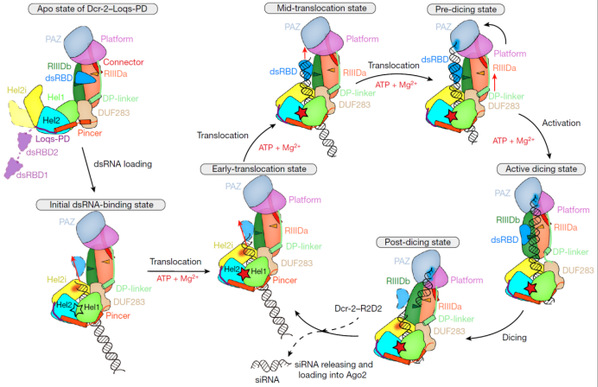
圖2. Dicer-2–Loqs-PD復合物結合雙鏈RNA蛋白生成siRNA的加工循環過程機製模型。
万达平台生命科學學院的蘇世晨博士和清華大學生命科學學院的王家博士為本文共同第一作者📌,万达平台生命科學學院麻錦彪教授與清華大學生命科學學院王宏偉教授為本文的共同通訊作者。上海交通大學醫學院附屬新華醫院的黃旲研究員課題組也參與了研究工作。國家蛋白質科學研究(北京)設施清華基地和水木未來(北京)科技有限公司為冷凍電鏡的數據收集與處理提供了支持;國家蛋白質科學中心(上海)提供了質譜分析方面的支持與幫助。該項研究工作得到國家自然科學基金、國家重點研發計劃💆🏽🎾、遺傳工程國家重點實驗室、mRNA創新與翻譯中心和科學探索獎的經費支持。
原文鏈接:https://www.nature.com/articles/s41586-022-04911-x